Leki biopobobne w UE
Leki biologiczne: informacje ogólne
Leki biologiczne zawierają substancje czynne pochodzenia biologicznego, takiego jak żywe komórki lub organizmy. Leki te mają ugruntowaną pozycję w praktyce klinicznej i w wielu przypadkach są niezbędne do leczenia ciężkich i przewlekłych schorzeń, takich jak cukrzyca, choroby autoimmunologiczne i nowotwory.
Najistotniejsze cechy leków biologicznych
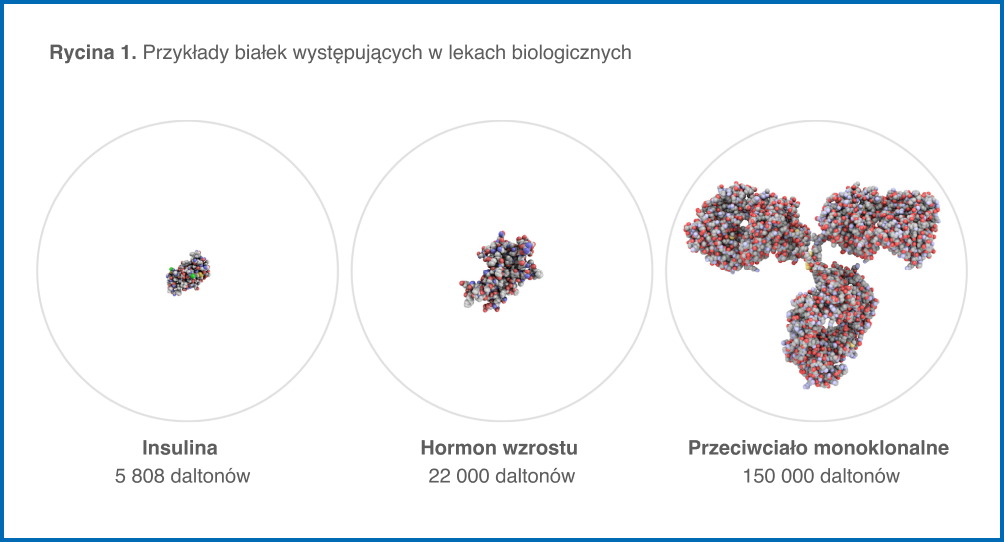
Większość obecnie stosowanych klinicznie leków biologicznych zawiera substancje czynne składające się z białek. Mogą one różnić się rozmiarem i strukturą, począwszy od białek prostych, jak insulina lub hormon wzrostu, po białka bardziej złożone, takie jak czynniki krzepnięcia krwi lub przeciwciała monoklonalne (ryc. 1).
Ścisła kontrola wytwarzania leków biologicznych
Wytwarzanie leków biologicznych jest zwykle bardziej złożonym procesem niż pozyskiwanie cząsteczek wytworzonych chemicznie. Większość leków biologicznych produkowanych jest z zastosowaniem metod biotechnologicznych, często wykorzystujących skomplikowane systemy komórkowe i technologię rekombinacji DNA. Prawodawstwo unijne narzuca ściśle określone wymogi w procesie wytwarzania leków:
producenci unijni muszą posiadać zezwolenie na wytwarzanie i są prawnie zobowiązani do przestrzegania zasad dobrej praktyki wytwarzania (GMP), tj. zapewniającej uzyskanie leku o udowodnionej jakości;
narodowe organy kompetentne w krajach UE (w Polsce – Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych) regularnie przeprowadzają kontrole miejsc wytwarzania leków pod względem zgodności z wymogami GMP;
jeżeli niektóre etapy wytwarzania odbywają się poza granicami UE, producenci spoza UE, importerzy i hurtownicy są zobowiązani do przestrzegania takich samych, ściśle określonych wymogów, jak również podlegają oni regularnym kontrolom.
W przypadku leków biologicznych niektóre wymogi GMP zostały dostosowane, tak aby uwzględnić specyfikę tych leków (np. stosowanie odpowiednich technik aseptycznych, przechowywanie w lodówce i inne warunki przechowywania, trwałość, transport itp.).
Struktura wielkocząsteczkowa
W porównaniu z niewielkimi substancjami chemicznymi leki biologiczne składają się z dużych i często złożonych struktur cząsteczkowych. Do badania ich właściwości fizykochemicznych i funkcjonalnych, takich jak struktura cząsteczkowa, modyfikacje białek i aktywność biologiczna, wykorzystuje się zaawansowane metody analityczne (np. mapowanie peptydów, spektrometrię masową i testy komórkowe).
Nieodłączny stopień zmienności
Leki biologiczne są wytwarzane przez żywe organizmy, które są zmienne z natury. Substancja czynna w gotowym leku biologicznym może zatem cechować się pewnym nieodłącznym stopniem nieznacznej zmienności („mikroheterogennością”). Ta nieznaczna zmienność musi mieścić się w dopuszczalnym zakresie, tak aby zapewnić jednolity poziom bezpieczeństwa i skuteczności. Osiąga się to poprzez opracowanie takiego procesu wytwarzania, aby zagwarantować, że właściwości otrzymywanej substancji czynnej będą mieścić się w pożądanym, ustalonym zakresie.
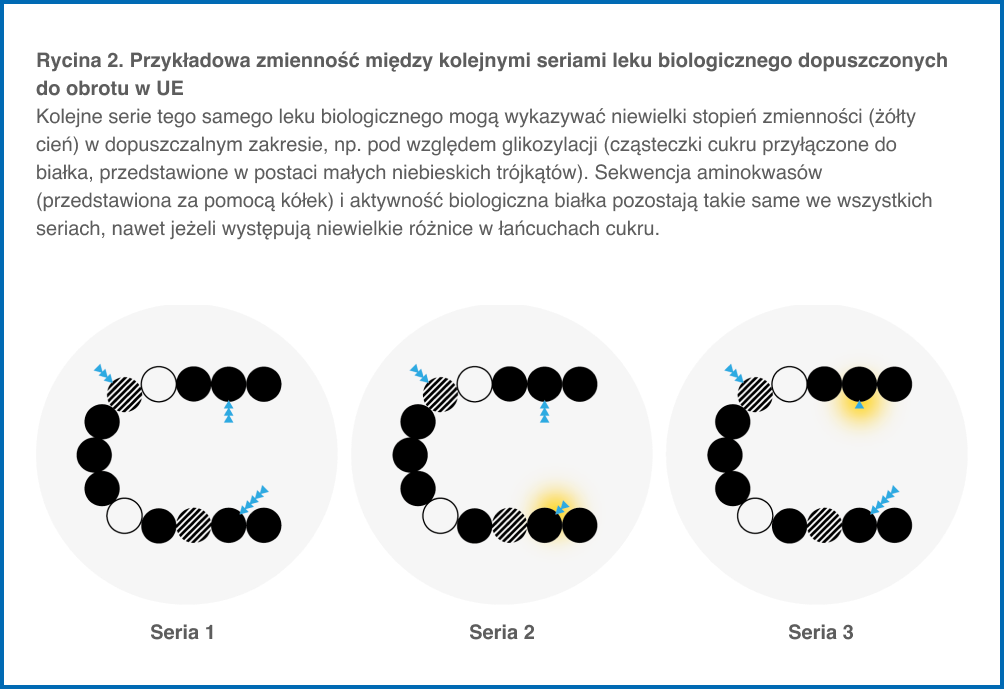
Tego rodzaju stopień nieznacznej zmienności może występować w obrębie jednej serii lub między seriami tego samego leku biologicznego (ryc. 2), w szczególności w przypadku gdy procesy wytwarzania są modyfikowane po dopuszczeniu produktu do obrotu, podczas obecności produktu na ryku (np. zwiększenie wielkości produkcji). Ścisłe kontrole serii są zawsze prowadzone aby pomimo tej zmienności, zapewnić stałość jakości kolejnych serii oraz aby zagwarantować, że te niewielkie różnice (w obrębie jednej serii lub między seriami) nie mają wpływu na bezpieczeństwo i skuteczność leku. W praktyce, jeżeli stosuje się ten sam proces wytwarzania, zmienność w obrębie jednej serii lub między seriami jest niewielka.
Ścisła kontrola jakości leków biologicznych
Jakość wszystkich leków (biologicznych i nie-biologicznych) dopuszczonych do obrotu w UE jest rygorystycznie kontrolowana. W odniesieniu do leków biologicznych kontrola ta obejmuje badania ich specyficznych właściwości fizykochemicznych, aktywności biologicznej, zawartości zanieczyszczeń, jałowości i trwałości, aby zapewnić spełnienie wszystkich wymaganych norm, zanim poszczególne serie zostaną dopuszczone do obrotu.
Potencjalna immunogenność
Układ odpornościowy posiada zdolność rozpoznawania obcych białek i reagowania na nie. Leki biologiczne zazwyczaj nie wywołują odpowiedzi immunologicznej, lecz gdy do tego dojdzie, jest ona ograniczona (np. przejściowe pojawienie się przeciwciał). Działania niepożądane o charakterze immunologicznym (np. reakcje związane z wlewem/infuzją lub reakcje w miejscu wstrzyknięcia) zwykle nie są ciężkie. W rzadkich przypadkach odpowiedź immunologiczna na lek biologiczny może być jednak ciężka i zagrażać życiu. Przeciwciała skierowane przeciwko lekowi biologicznemu („przeciwciała anty-lek”, nazywane też w skrócie „ADA – anti-drug antibodies”) mogą również zneutralizować działanie leku i zmniejszyć jego skuteczność. W związku z tym potencjalna immunogenność każdego leku biologicznego musi być zawsze oceniona.
Naturalna zmienność jest nieodłączną cechą wszystkich leków biologicznych, przy czym podczas ich wytwarzania zawsze prowadzone są ścisłe kontrole, aby zagwarantować, że nie wpłynie ona na sposób działania lub bezpieczeństwo leku.
Leki biopodobne: definicja i charakterystyka
Lek biopodobny jest to lek biologiczny wykazujący wysokie podobieństwo do innego, już wprowadzonego do obrotu w UE, leku biologicznego (tzw. leku referencyjnego)1,2. Podmioty odpowiedzialne mogą wprowadzać do obrotu leki biopodobne po upływie okresu ochrony rynkowej leku referencyjnego (po 10 latach).
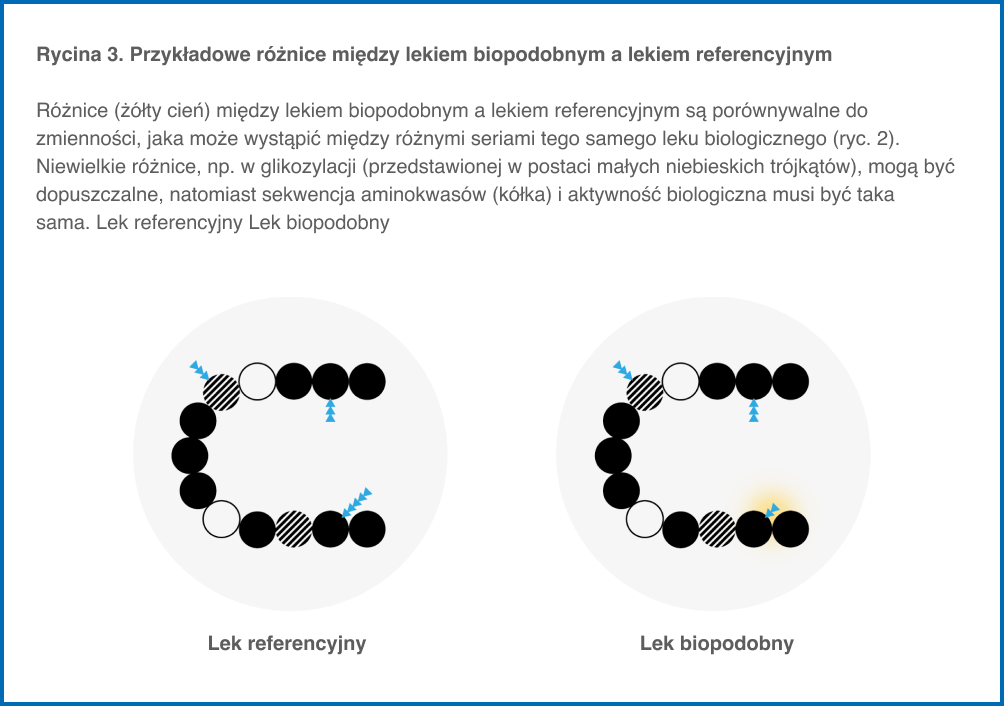
Leki biopodobne są lekami biologicznymi, w związku z tym wszystkie charakterystyczne właściwości leków biologicznych odnoszą się również do leków biopodobnych. Ze względu na naturalną zmienność źródła biologicznego i unikalny dla każdego producenta proces wytwarzania mogą wystąpić niewielkie różnice między lekiem biopodobnym a jego lekiem referencyjnym (tabela 1 i ryc. 3). Podczas wytwarzania zawsze prowadzone są ścisłe kontrole, aby zagwarantować, że te niewielkie różnice nie wpłyną na sposób działania leku czy jego bezpieczeństwo. Różnice te nie są istotne klinicznie pod względem bezpieczeństwa czy skuteczności.
Tabela 1. Cechy szczególne leków biopodobnych
| Wysokie podobieństwo do leku referencyjnego | Właściwości fizyczne, chemiczne i biologiczne leku biopodobnego wykazują wysokie podobieństwo do właściwości leku referencyjnego. Mogą wystąpić niewielkie różnice w porównaniu z lekiem referencyjnym, ale nie są one istotne klinicznie pod względem bezpieczeństwa czy skuteczności. |
| Brak istotnych klinicznie różnic w porównaniu z lekiem referencyjnym | Nie przewiduje się różnic w skuteczności klinicznej. Badania kliniczne, na podstawie których zatwierdza się lek biopodobny, potwierdzają, że ewentualne różnice nie będą mieć wpływu na bezpieczeństwo i skuteczność leku. |
| Zmienność leku biopodobnego utrzymywana w ściśle określonych granicach | Nieznaczna zmienność jest dopuszczalna jedynie wówczas, gdy dowody naukowe wykazują, iż nie wpływa ona na bezpieczeństwo ani skuteczność leku biopodobnego. Zakres zmienności dozwolonej dla danego leku biopodobnego jest taki sam jak zakres zmienności dozwolonej między seriami leku referencyjnego. Osiągane jest to dzięki sprawdzonemu procesowi wytwarzania, który zapewnia wysoką jakość wszystkich serii leku. |
| Takie same rygorystyczne normy jakości, bezpieczeństwa i skuteczności | Leki biopodobne uzyskują pozwolenie na dopuszczenie do obrotu na podstawie tych samych ścisłych norm jakości, bezpieczeństwa i skuteczności, które mają zastosowanie do wszystkich innych leków. |
Jeżeli substancja czynna jest białkiem, lek biopodobny i lek referencyjny muszą zawierać to samo białko (tj. tę samą sekwencję aminokwasów) o tej samej strukturze „3D” (struktura przestrzenna białka). Sekwencja aminokwasów i struktura przestrzenna białka to główne czynniki określające aktywność biologiczną, która musi być taka sama w przypadku leku biopodobnego i leku referencyjnego.
Gotowe leki biopodobne i referencyjne muszą być tak samo dawkowane i muszą posiadać taką samą drogę podania. Dopuszczalne są pewne różnice o ile nie mają one wpływu na bezpieczeństwo i skuteczność leku, np. różnice w składzie substancji pomocniczych leku, różnice w postaci farmaceutycznej (np. proszek do sporządzenia roztworu a gotowy roztwór do wstrzyknięcia) i różnice aplikatora (np. rodzaj penu do wstrzykiwania).
Dlaczego leki biopodobne nie są uznawane za leki generyczne
Leku biopodobnego nie uznaje się za odtwórczy (generyczny) odpowiednik leku biologicznego. Wynika to przede wszystkim z faktu, że naturalna zmienność i bardziej złożony sposób wytwarzania leków biologicznych nie pozwalają na dokładne odtworzenie mikroheterogenności cząsteczkowej.
W rezultacie, przed wydaniem pozwolenia na dopuszczenie do obrotu, wymagana jest większa liczba badań niż dla leku generycznego aby wykazać, iż niewielkie różnice pomiędzy lekiem biopodobnym a referencyjnym nie mają wpływu na skuteczność i bezpieczeństwo leku biopodobnego.
Tabela 2. Porównanie badań rozwojowych oraz cech charakterystycznych leków generycznych i leków biopodobnych
| Lek odtwórczy | Lek biopodobny |
|---|---|
| Zwykle wytwarzany w drodze syntezy chemicznej | Uzyskiwany ze źródła biologicznego |
| Zasadniczo możliwe jest uzyskanie identycznej cząsteczki | Ze względu na unikalne metody wytwarzania leków biologicznych i naturalną zmienność biologiczną istnieje jedynie możliwość odtworzenia cząsteczki wykazującej wysokie podobieństwo |
| W większości mniejsze, łatwiejsze do scharakteryzowania cząsteczki | Większe cząsteczki o bardziej złożonej strukturze, które wymagają wykorzystania wielu technologii w celu ich scharakteryzowania |
| Pełne wymagania dotyczące jakości farmaceutycznej | Pełne wymagania dotyczące jakości farmaceutycznej oraz dodatkowe badania jakościowe porównujące budowę i aktywność biologiczną leku biopodobnego i leku referencyjnego |
| Badanie mające na celu wykazanie biorównoważności (tj. takiej samej szybkości i stopnia uwalniania substancji czynnej leku referencyjnego i odtwórczego w podobnych warunkach) | Wykazanie biopodobieństwa w badaniach porównawczych (kompleksowe bezpośrednie porównanie leku biopodobnego i leku referencyjnego w celu wykazania wysokiego podobieństwa w strukturze chemicznej, funkcji biologicznej, skuteczności, bezpieczeństwie i immunogenności) |
| Wymogi w zakresie danych klinicznych obejmują przede wszystkim farmakokinetyczne badania biorównoważności | Oprócz porównawczych badań farmakokinetycznych i farmakodynamicznych wymagane mogą być również dane dotyczące bezpieczeństwa i skuteczności, zwłaszcza w przypadku bardziej złożonych leków biologicznych |
| Wszystkie wskazania do stosowania zatwierdzone dla leku referencyjnego mogą zostać przyznane na podstawie wykazanej biorównoważności bez potrzeby przedstawiania dodatkowych danych klinicznych | W odniesieniu do każdego wskazania do stosowania należy uzasadnić skuteczność i bezpieczeństwo leku. Badania kliniczne leku biopodobnego zazwyczaj nie są jednak potrzebne w odniesieniu do każdego wskazania zatwierdzonego dla leku referencyjnego. Po wykazaniu biopodobieństwa możliwa jest ekstrapolacja danych dla pozostałych wskazań, jeżeli dostępne dowody naukowe odnoszą się do wszystkich aspektów tych wskazań |
Raport dostępny na stronie:
https://www.ema.europa.eu/en/documents/leaflet/biosimilars-eu-information-guide-healthcare-professionals_pl.pdf